医疗器械唯一标识咨询问答(六)
1. 问:UDI载体使用了符合标准的GS1-128或GS1 DataMatrix,为什么使用环节扫码时只能读出一长串数字字母字符,没有按不同应用标识符分开?
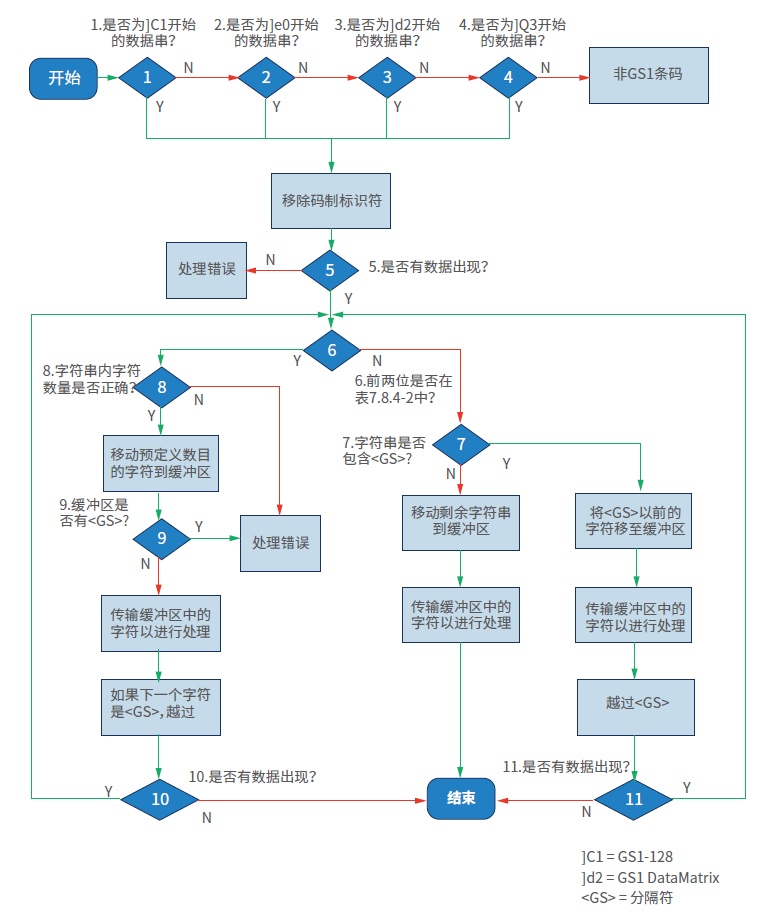
答:建议确认扫码设备是否设置到了识读GS1相应条码的模式,相关软硬件是否并按照GS1标准对条码进行了处理,GS1条码符号数据处理流程见下图,详见GS1条码符号处理流程详见《GS1通用规范》7.8。
2. 问:实施了UDI是否就实现了追溯?
答:《医疗器械监督管理条例》(中华人民共和国国务院令第739号)提到“国家根据医疗器械产品类别,分步实施医疗器械唯一标识制度,实现医疗器械可追溯”。国家药监局关于做好第一批实施医疗器械唯一标识工作有关事项的通告(2019年第72号)也提到“鼓励注册人应用医疗器械唯一标识建立医疗器械信息化追溯系统,实现对其产品生产、流通、使用全程可追溯。鼓励医疗器械生产经营企业、使用单位在其相关管理活动中积极应用医疗器械唯一标识,探索建立与上下游的追溯链条,推动衔接应用。”
UDI系统可实现医疗器械标识和产品主数据的记录,实施追溯还需要供应链各环节通过追溯系统对产品的历史记录、位置或应用信息进行记录。
3. 问:医疗机构实施UDI的步骤有哪些?
答:
(1)组建团队:涉及所有临床科室、耗材管理职能科室及信息科,需要由院领导牵头,统一实施应用。
(2)学习相关法规政策:UDI法规、政策、标准等
(3)改造系统:涉及院内各个系统,以UDI数据库字段标准为基础,改造系统数据库架构,实现通过扫描自动填充数据到系统的功能。升级扫码设备。
(4)获取国家UDI数据:选择接口对接或下载的方式,获取国家局UDI数据库。
(5)DI对码:对院内自编码、DI、医保分类编码、计费编码进行对码关联。
(6)应用:采购、收货、验收、入库、出库、使用、结算、不良事件等各个场景应用UDI关联记录。建立院内追溯体系。
4. 问:医疗机构实施UDI的步骤有哪些?
答:
(1)组建团队:涉及所有临床科室、耗材管理职能科室及信息科,需要由院领导牵头,统一实施应用。
(2)学习相关法规政策:UDI法规、政策、标准等。
(3)改造系统:涉及院内各个系统,以UDI数据库字段标准为基础,改造系统数据库架构,实现通过扫描自动填充数据到系统的功能。升级扫码设备。
(4)获取国家UDI数据:选择接口对接或下载的方式,获取国家局UDI数据库。
(5)DI对码:对院内自编码、DI、医保分类编码、计费编码进行对码关联。
(6)应用:采购、收货、验收、入库、出库、使用、结算、不良事件等各个场景应用UDI关联记录。建立院内追溯体系。
5. 问:医疗机构耗材数据为什么要进行对码?
答:医用耗材数据进行对码的主要原因:(1)与国家UDI数据库对接,把好耗材进院质量关。(2)提高UDI进院扫码效率。UDI在医疗机构院内实施后,实物进院时,进行UDI扫码,如果院内耗材数据未与DI映射,则无法实现UDI编码的解析;同时,无法通过实物UDI标签中的DI和国家UDI数据库DI匹配核对来确认实物耗材真伪。(3)DI具有医用耗材唯一身份属性,现有耗材数据通过对码映射获取国家UDI数据库中的DI,有利于院内耗材数据唯一身份的管理。
6. 问:医疗机构如何进行DI对码工作?
答:手动对码工作量大,效率低。可使用“UDI服务公益平台”自动对码。该平台注册登录后可免费使用UDI-DI对码、数据规范化诊断、资质管理的功能模块。平台位置:中国医疗器械信息网(https://www.cmdi.org.cn/)首页可登录,也可直接访问网址http://udi.cmic.com.cn/udi/#/login。
7. 问:UDI服务公益平台注册后怎么登录不了?
答:UDI服务公益平台供医疗机构用户使用,注册时,需要上传医疗机构执业许可证,注册提交后,平台进行账号审批(通常1-2个工作日)。审核通过,才能登录使用,使用过程中遇到问题,可拨打首页电话010-84438357进行免费咨询。
8. 问:进行对码时,为什么对码比例那么低?
答:使用UDI服务公益平台对码,实质是,医疗机构的数据和国家UDI数据库的数据在进行自动映射,对码不匹配的原因是:(1)医疗机构数据不规范,国家UDI数据库中的数据是生产厂家根据医疗器械注册证信息进行填报的,双方数据有差异则不能自动匹配,需要先进行数据规范化转化之后,再进行对码。(2)国家UDI数据库中还没有该对码数据,目前国家UDI数据库中的数据是生产厂家根据国家推进UDI的进度要求来进行上报,并不是所有的医疗器械的数据均已上报。
9. 问:DI对码时,能和耗材国家医保分类与代码同时映射吗?
答:DI编码主库为国家UDI数据库,国家医保分类与代码主库为国家医保局数据库,两个数据库的建设主体和数据内容不同,都是由生产厂家分别进行填报,同步维护两个编码信息,在进行DI对码时,如果国家UDI数据库中已上传了耗材国家医保分类与代码,则DI对码时,耗材国家医保分类与代码会实现同步映射。
10. 问:实施UDI过程中遇到UDI数据库操作相关问题可联系哪里?
答:可通过国家药监局医疗器械唯一标识数据库网站“帮助台”提交问题。
11. 问:UDI的相关政策和文件如何查询?
答:可到国家药监局官方网站查询,具体网址https://udi.nmpa.gov.cn/toMessageList.html?flag=2
也可到北京市药监局官方网站查询,具体网址http://yjj.beijing.gov.cn/yjj/ztzl48/ylqxjgfwzn/ylqxsc47/index.html。
12. 问:产品有多种销售包装形式如1支装,5支装,以哪个包装作为最小销售单元呢?
答:分两种情况:
1.一支装作为单个包装DI是主DI--A,5支装的DI--B(其包含的单支产品也附加了UDI,且为DI—A),那么A是最小销售单元DI,B是包装DI
2.一支装作为单个包装DI是主DI--A,5支装的DI--B(其包含的单支产品与A的产品相同,但未附加UDI),那么B也是主DI,且B的最小使用单元 DI不能与主DI—A相同。
(《国家药品监督管理局医疗器械唯一标识管理信息系统数据填报说明V3版》20211008)
13. 问:产品最小销售单元是盒,每盒里有12个,单个产品是否也需要有DI呢?
答:根据《医疗器械唯一标识系统规则》第十二条,注册人/备案人应当选择与其创建的医疗器械唯一标识相适应的数据载体标准,对以其名义上市的医疗器械最小销售单元和更高级别的包装或者医疗器械产品上赋予唯一标识数据载体。因此单片产品作为使用单元可以不进行实物赋码,但在国家数据库填写DI数据时,当最小销售单元中使用单元的数量大于1时,需分配给单个医疗器械产品的使用单元产品标识,其目的是将医疗器械产品的使用与患者进行关联。
14. 问:当时注册时未提交过产品标识,UDI数据库中“是否与注册/备案产品标识一致”一栏如何填写?注册后产品实际销售使用的主DI可以与注册时提交的产品主DI不同吗?
答:按照《医疗器械唯一标识系统规则》内容要求,2019年10月1日起,注册人/备案人应当在申请医疗器械注册、注册变更或者办理备案时,在注册/备案管理系统中提交其产品标识;2019年10月1日之前的注册/备案证产品选择“是否与注册/备案产品标识一致”时,默认选择是。
如果产品上市销售由于特殊原因最小销售单元标识不得已发生变更,与注册/备案时提交时不同,在UDI数据库申报数据时,需在“是否与注册/备案产品标识一致”一栏填否,在 “注册/备案产品标识”一栏填写注册/备案审批时所填报的最小销售单元DI。
(《国家药品监督管理局医疗器械唯一标识管理信息系统数据填报说明V3版》20211008)
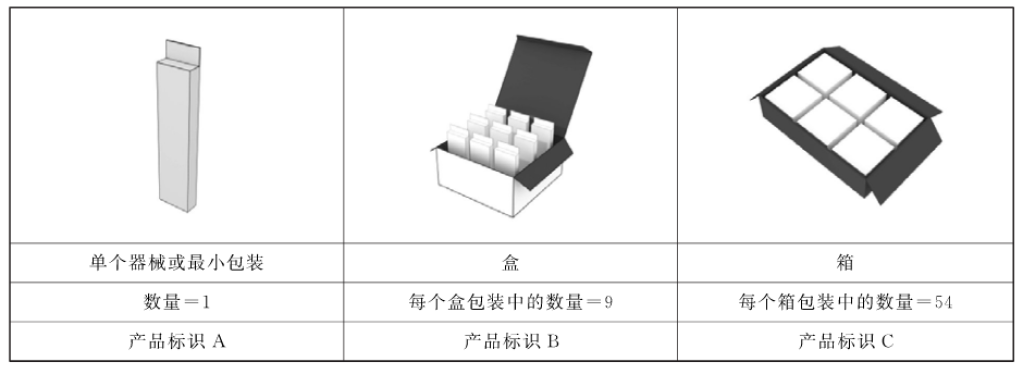
15. 问:某医疗器械产品每箱有54盒,每盒有9支,最小销售单元是支,不同包装层级的DI如何分配,是否需要不同?
答:不同包装层级需要有不同DI(不包括运输包装)。注册人/备案人应当在最小销售单元和更高级别的包装或者医疗器械产品上赋予唯一标识,且给各级别的器械包装分配不同的DI,确保DI的唯一性,参见下图。
(《医疗器械唯一标识系统规则》第十二条和YY/T 1630-2018《医疗器械唯一标识基本要求》附录B)
